隨著COVID-19疫情反覆肆虐,各國的疫控措施也不停動態調整,唯一不變的是「核酸檢測」在此過程總是扮演著最後診斷的黃金標準。而隨著病毒傳播速度越來越快,核酸檢測的方法也因應前線醫護人員的需求,由傳統大型實驗室的檢測方式,演變成更具即時性、便利性的快速型核酸檢測;而核酸檢測要兼具快速性、可靠度,必須要先掌握溫控的精準度。
在各式核酸檢測的方法學中,聚合酶鏈鎖反應 (Polymerase Chain Reaction,簡稱PCR) 為現今主流檢測技術 (如圖一所示)。其透過高溫加熱使DNA變性 (Denaturation) 解開成兩股單鏈,接著透過降溫退火 (Annealing) 來使高專一性的PCR試劑與前述之兩股單鏈黏合後進行複製延伸 (Extension)。透過重複N次的高、低溫循環,即可讓樣本以2N指數級別進行擴增放大,從而透過訊號偵測來判斷標的物是否存在。因此,溫控的精準度會影響核酸檢測的精確度。
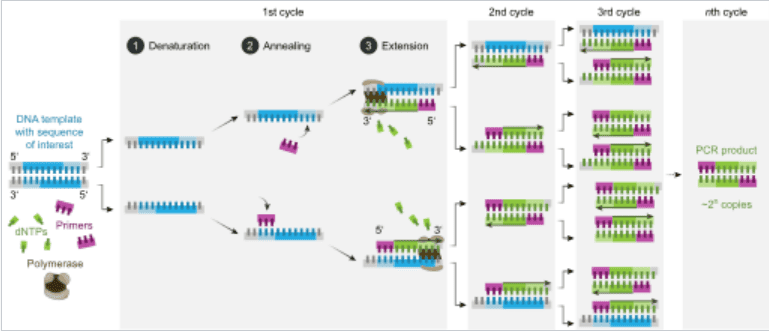
傳統大型PCR檢測,為求精準控溫,拉長整體檢測時間
從前述之原理介紹,可以了解各段作用溫度之控制是否得當會直接影響核酸擴增放大之效率,舉例來說:高溫變性溫度過高,將導致酵素之活性衰減、低溫退火溫度過低會致使PCR試劑專一性低 (非特異性擴增)。因此,在一般大型PCR檢測設備的溫度控制設計上,大多採用均溫較佳的加熱底座與較穩健的溫控策略,但整體檢測時間 (平均約需1~2小時) 就會因而受限於保守的升/降溫速度而難以進一步縮短。
快速PCR檢測的挑戰:研發兼具檢測速度與精準度的溫控方案
而分子診斷 (Molecule Diagnostics) 在COVID-19疫情推波助瀾下,逐漸朝向「去中心化 (Decentralized)」發展,有越來越多的核酸檢測設備需可在一般診間或第一線做即時檢驗 (Point-of-care Testing),也讓「快速檢測」成為了主要開發重點。
綜觀目前市場上相關核酸檢測產品,可以歸納出快速PCR的溫控實現手段有兩大類:
(1) 靜態式液體加熱:為了提升熱控速度,透過將耗材卡匣內的液體鋪展成一薄膜形式來增加受熱面積,並搭配儀器端不同的快速溫控模組,包含「多單元致冷晶片 (TEC) 合併熱控」、「多區恆溫塊熱接觸運動操控」與「非接觸式光加熱 (包含遠紅外線直接加熱、熱誘發摻雜於液體的奈米粒子來間接加熱等方式)」,來精準控制溫度。
(2) 動態式液體加熱:透過推動耗材卡匣內之液體在多個恆溫區塊流通與加熱,包含「連續式流通於蜿蜒蛇型流道」、「往復式流動於多恆溫區塊 (包含有氣壓推動液體、彈性壁變形擠壓推動液體、電潤濕控制液滴移動等方式)」,以更精確地控制溫度。
從前述的技術分類彙整比較來看,快速PCR之關鍵在於如何讓待加熱之液體盡可能提升單位體積的表面積大小(包含薄膜、微型反應槽陣列或微液滴等形式),並搭配機器端提供快速高、低溫切換的熱循環精準控制,惟有兩者相輔相成才能創造出一快速、高效與可靠的核酸檢測系統。
高整合度的系統性設計,方能推進快速核酸檢測普及
總結來說,隨著核酸檢測逐漸從傳統大型實驗室走出至第一線醫療場域、更甚是發展為簡便易用的家用設備趨勢來看,「檢測快速」、「操作便利」與「品質可靠」是目前開發去中心化的核酸檢測設備所需考量之要點,而精準快速溫控技術之開發更是箇中之關鍵。未來惟有系統性設計「試劑」、「卡匣」與「設備」的介面整合與生產製造,才能讓核酸檢測真正普及化而提升人類健康福祉。
延伸閱讀:

